Энергия гидратации ионов
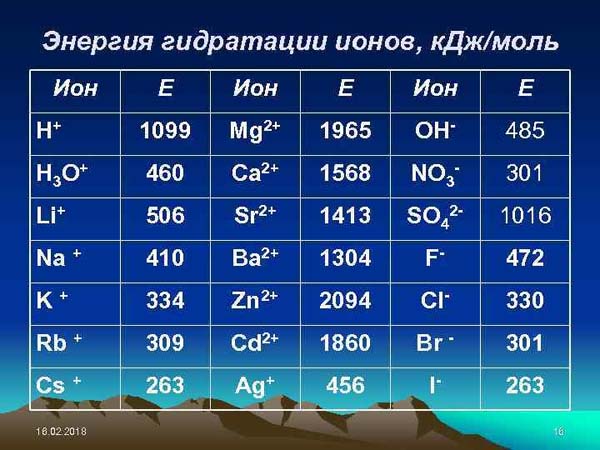
Энергия гидратации — энергия (Я), выделяющаяся при взаимодействии молекул воды с ионами растворяющегося вещества. Является важнейшей величиной в энергии, обеспечивающей возможность растворения ионных или диссоциирующих на ионы соединений и определяющей теплоту растворения (L ). Величина Э. г. для воды (а для др. растворителей — энергии сольватации) определяется диэлектрической постоянной для воды, равной 81. Это означает, что взаимодействие единичного положительного или отрицательного заряда в такой среде уменьшается в 81 раз, что и способствует растворению при совокупном влиянии тепловой энергии на подвижность ионов и атомов — кинетической энергии. Значение Э. г. состоит и в нередко преобразующей роли характера связей в соединениях, образующихся при кристаллизации из водных растворов, становящихся более ионными в сравнении с кристаллизацией из расплавов. Э. г. играет важнейшую роль в явлениях катионного обмена. Чем выше Э. г. иона при прочих равных условиях (валентности, концентрации), тем охотнее он переходит в раствор в обмен на катионы с меньшей Э. г.
До последнего времени представлялось, что Э. г. есть результат чисто электростатического взаимодействия как анионов, так и катионов с дипольными зарядами молекул воды. Поэтому величина Э. г. соединений (Н) вычислялась на основе представлений об энергии кристаллической решетки (V) с поправкой на теплоту растворения (L); Н = U + L. Из таких Э. г. соединений вычислялись и Э. г. ионов, сводившихся в таблицы (Мищенко, 1952). Однако на основе новой системы ионно-атомных радиусов механизм взаимодействия катионов с молекулами воды представляется иным. По Лебедеву (1968), между катионами и молекулами воды связь, вероятно, донорно-акцепторная и только между анионами и молекулами воды скорее электростатическая. В. И. Лебедев.
Поделиться с друзьями
