Двойной электрический слой строение
Двойной электрический слой строение граница возникновение образование теория
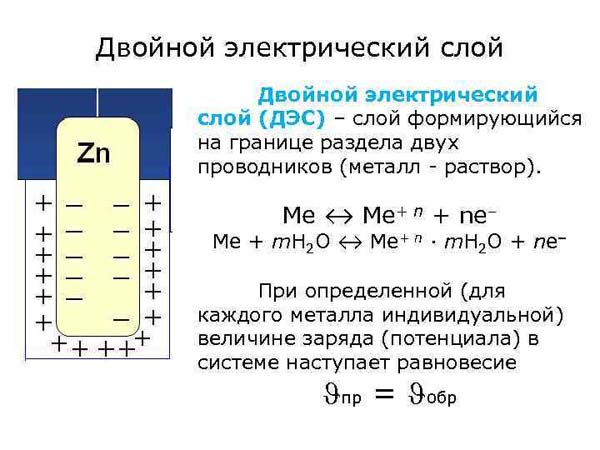
Двойной электрический слой, тонкий поверхностный слой из пространственно разделенных электрич зарядов противоположного знака, образующийся на границе двух фаз Поскольку пространств разделение зарядов всегда сопровождается возникновением электрич разности потенциалов, Двойной электрический слой можно рассматривать как своеобразный микроконденсатор, расстояние между обкладками которого определяется молекулярными размерами Образование Двойной электрический слой оказывает существенное влияние на скорость электродных процессов, адсорбцию ионов и нейтральных молекул, устойчивость дисперсных систем, смачиваемость, коэф трения и др свойства межфазных границ В биол системах процессы образования и разрушения Двойной электрический слой на клеточных мембранах сопровождают распространение электрич импульсов вдоль нервных и мышечных волокон
Двойной электрический слой строение
Наиболее детально строение Двойного электрического слояизучено на границе между металлич электродом и р-ром электролита При погружении металлич электрода М в р-р электролита, содержащий ионы этого металла М+ (потенциалопределяющие ионы), устанавливается электрохим равновесие, сопровождаемое выравниванием электрохим потенциалов этих ионов в кристаллин решетке металла и в р-ре Если первоначально электрохим потенциал ионов М + в металле mм+м был больше электрохим потенциала этих ионов в р-ре mм+p, то в процессе выравнивания этих величин нек-рое кол-во ионов М+ переходит из металла в р-р и пов-сть металла заряжается отрицательно Притянутые к ней кулоновскими силами катионы из р-ра (не обязательно М+ ) образуют положит обкладку Д. э. с. Возникающая при этом электрич разность потенциалов препятствует дальнейшему переходу ионов М + из металла в р-р, что и приводит к установлению электрохим равновесия Если первоначально mм+м < mм+p, то при установлении электрохим равновесия часть ионов М+ из р-ра переходит на металл, заряжая его поверчсть положительно Отрицат обкладку Двойной электрический слой в этом случае составляют притянутые к пов-сти металла анионы р-ра Путем подбора концентрации потенциалопределяющих ионов в р-ре можно добиться такой ситуации, что условие mм+м = mм+p не требует перехода ионов М+ из металла в р-р или наоборот В этом случае заряд пов-сти металла равен нулю, а его потенциал, измеренный относительно к -л электрода сравнения, наз потенциалом нулевого заряда Условия положительно заряженной, отрицательно заряженной и незаряженной пов-сти металла можно осуществить и в том случае, если в р-ре электролита нет потенциалопределяющих ионов Для этого необходимо внести в р-р кроме данного металлич электрода М к -л вспомогат электрод и подсоединить оба электрода к внеш источнику постоянного напряжения В зависимости от величины и знака напряжения источника можно произвольно изменять заряд q пов-сти металла М При q > 0 ионную обкладку Двойного электрического слоя образуют притянутые из р-ра анионы, при q < 0-катионы
При потенциале нулевого заряда, когда q = 0, ионный Д.э.с отсутствует, но разность потенциалов на границе р-р|металл (гальвани-потенциал) не равна нулю, т к на этой границе существуют так называемый адсорбционный и электронный Двойной электрический слой Адсорбционный Двойной электрический слой связан с некулоновской (специфической) адсорбцией ионов или полярных молекул Так, напр, на границе ртуть|водный р-р KI при q = 0 донорно-акцепторное взаимод приводит к специфич адсорбции анионов I-, к-рые уже вследствие кулоновского взаимод притягивают эквивалентное кол-во катионов К + При этом электрич центры анионов I- оказываются ближе к пов-сти ртути, чем электрич центры катионов К + , и пространств разделение зарядов ведет к образованию адсорбционного Двойного электрического слоя, отрицательная обкладка к-рого обращена в сторону металла Полярные молекулы растворителя или растворенных нейтральных в-в, как правило, адсорбируются на электроде таким образом, что средняя нормальная к пов-сти состав ляющая дипольного момента не равна нулю Ориентиров адсорбция диполей поэтому также приводит к образованию адсорбционнго Двойного электрическоро слоя Напр, при адсорбции молекул бутилового спирта из водного р-ра на незаряженной пов-сти ртути гидрофобные углеводородные радикалы С4Н9, несущие по дожит заряд диполя, ориентированы в сторону пов-сти, а гидрофильные ОН-группы, на к-рых сосредоточен отрицат заряд, ориентированы в сторону р-ра Адсорбционный Двойной электрический слой может образоваться также и при адсорбции неполярных частиц, если их донорно-акцепторное взаимод с электродом сопровождается возникновением наведенного дипольного момента (напр, при адсорбции на электродах атомов Н или О)
Электронный Двойной электрический слой обусловлен квантовомех св-вами электронов в металлах и полупроводниках Согласно совр моделям металла как электронного газа и ионного остова электронный Д. э. с связывают с тем, что электронный газ несколько выходит за пределы ионного остова, что и приво дат к пространств разделению зарядов При этом своей положит обкладкой Дэе обращен к металлу, отрицательной-к контактирующей с металлом фазе (р-ру или газу) В полупроводниках из-за малого кол-ва носителей тока (электронов в Зоне проводимости и «дырок» в валентной зоне) при наложении внеш, напряжения возникает их неравномерное пространств, распределение в поверхностном слое, к-рое рассматривают как электронный Двойной электрический слой. внутри полупроводниковой фазы. В общем случае Двойной электрический слой, вызванные разными причинами, накладываются друг на друга, что приводит к весьма сложной структуре границы раздела между Электродом и р-ром.
Возникновение Двойного электрического слоя. на границе непроводящего твердого тела с р-ром связано либо с адсорбцией, либо с взаимод. поверхностных ионогенных групп твердого тела С молекулами р-рителя. Так, напр., кристаллы Agl, полученные по р-ции KI + AgNO3 -> Agl + KNO3, в р-рах с избытком KI адсорбируют ионы Г и заряжаются отрицательно, в р-рах с избытком AgNO, адсорбируют ионы Ag+ и заряжаются положительно. При этом к заряженной пов-сти Agl под действием электростатических сил притягиваются ионы противоположного знака, образующие ионную обкладку Д. э. с. С другой стороны, взаимод. поверхностных ионогенных групп разл. оксидов с ионами Н3О + , ОН- и молекулами воды в зависимости от pH р-ра может приводить либо к положит., либо к отрицат. заряжению пов-сти оксида.
Методы изучения. Для исследования Двойного электрического слоя. используют в осноовном трн группы методов. Во-первых, адсорбц. методы, которые основаны на том, что образование Д. э. с связано с адсорбцией разл. компонентов р-ра и вызывает изменение их концентрации. В частности, адсорбц. методы широко используют для изучения Двойного электрического слоя, образованного на мелкодисперсных частицах в коллоидных системах. Во-вторых, методы, основанные На электрокапиллярных явлениях. Их сущность состоит в том, что образование Двойного электрического слоя уменьшает работу, необходимую для создания новой пов-сти раздела фаз, и тем самым приводит к зависимости межфазного натяжения от потенциала электрода. Применение электрокапиллярных методов ограничено границами раздела между жидкими фазами, на которых возможно непосредственное измерение межфазного натяжения; для твердых электродов эти методы дают лишь качеств, информацию о строении Двойного электрического слоя. В-третьих, методы, регистрирующие колличество электричества, затраченного на создание определенного заряда электрода (заряжение Двойного электрического слоя). Сюда относятся разл. гальва-ностатич. и потенциостатич. импульсные методы, а также метод измерения электрич. емкости Д. э. с. с помощью синусоидального переменного тока (см. Импедансный метод). Для успешного применения этих методов необходимо, чтобы все подведенное к электроду электричество Затрачивалось только на заряжение Двойного электрического слоя. и не расходовалось на электрохим. р-ции. Электроды, удовлетворяющие этому требованию, наз. идеально поляризуемыми. Сведения о строении Двойного электрического слоя на границе р-р,изолятор можно получить на основе изучения электрокинетических явлений.
Двойной электрический слой изучают также с помощью оптич. методов (эллипсометрия, разл. варианты электроотражения света, комбинационное рассеяние в адсорбц. слое и др.). На основе указанных методов можно определить заряд пов-сти электрода q, его зависимость от потенциала электрода Е, потенциал нулевого заряда Eq = 0, электрич. емкость Д. э. с., равную δq/δE, а также поверхностные избытки (адсорбции) разл. компонентов р-ра в зависимости от Е (или q) и их объемной концентрации.

Схвма распределения потенциал» в двойном электрическом слое: 1 - при |qI| < |q |; 2 -пря |qI| > | q |
Современная теория Д.э.с., основной вклад в развитие которой внесли работы Г. Гельмгольца (1879), Ж. Гуи (1910), Д. Чапмена (1913), О. Штерна (1924) и Д. Грэма (1947-58), базируется на след, модели ионной обкладки Д.э. с. Благодаря тепловому движению ионы, адсорбировавшиеся на электроде только под действием кулоновских сил, распределяются у пов-сти подобно молекулам газа в земной атмосфере и образуют диффузную часть Д.э.С. Границей диффузной части‘является т. наз. внеш, плоскость Гельмгольца х2 (рис.), до к-рой Могут дойти электрические центры ионов, участвующих в тепловом движении. Между внеш, плоскостью Гельмгольца и пов-стью металла располагается плотная часть Д.э.с., для к-рой характерна диэлектрин, проницаемость существенно меньшая, чем в объеме р-pa. В плотном слое локализуется дипольный Д.э.с, образованный ориентированными диполями р-рителя и орг. растворенного в-ва. Кроме того, в плотную часть Д.э.с. входят специфически адсорбирующиеся ионы; при этом их электрич. центры образуют т. наз. внутр, плоскость Гельмгольца ХI. В силу электронейтральности границы раздела плотность заряда q на электроде компенсируется зарядами специфически адсорбиров. ионов (qI) и ионов, находящихся в диффузной части Д. э. с. (q2) :q = — qI — q2.
Теория Д.э.с. позволяет связать величины q и qI с электрич. разностями потенциала в плотной и диффузной частях Д. э. с. Так, падение потенциала в плотной части Д.э.с. описывается ур-нием: ψu = q/K02 + qIK12, гдеt K02 и К12-интегральные емкости соотв. всего плотного слоя и пространства между внутр, и внеш, плоскостями Гельмгольца. Падение потенциала в диффузном слое (потенциал внеш, плоскости Гельмгольца) в р-ре 1,1-валентного электролита с концентрацией с равно: ψ0 = 2RT/Farcsh [(q+ q1)/2A√с], где А = √2RT1εoε εо -диэлектрин, постоянная, ε - диэлектрин, проницаемость р-рителя, a R, T и F- соотв. газовая постоянная, т-ра и число Фарадея. Потенциал внутр, плоскости Гельмгольца рассчитывают по ф-ле: ψI = (q + λqI)/Kl2 + ψo, где λ ≤ 1 - коэф., характеризующий дискретность специфически адсорбиров. ионов. Если |qI| > | q |, то говорят, что произошла «перезарядка поверхности» специфически адсорбиров. ионами. В этом случае потенциалы ψ0 и ψI; имеют знак, противоположный знаку общего скачка потенциала в ионном Д. э. с. ψ0 = ψI + ψ0 (см. рис., кривая 2).
Для развития теории дипольного Д.э.с., связанного с адсорбцией молекул р-рителя, успешно используется зависимость емкости К02, от q. Теоретич. расчеты электронного Д.э.с. пока крайне противоречивы; с целью упрощения принято считать, что скачок потенциала в электронном Д. э. с. металла не зависит от q и потому не вносит вклада в наблюдаемые эффекты.
Изучение св-в и строения Д.э.с. имеет большое значение для понимания и усовершенствования таких практически важных процессов, как электролиз, электроосаждение металлов, электрохим. р-ции в хим. источниках тока, коррозия металлов, коагуляция в коллоидных системах, флотация, ионный обмен и др.
Лит.: Дамаскин Б. Б., Петрий О. А., Введение в электрохимическую кинетику, 2 изд., М., 1983; Comprehensive treatise of electrochemistry, cd. by J.O’M. Bockris, В. E. Conway and E. Yeager, v. 1, N. Y.-L., 1980.-
Поделиться с друзьями
