Ацетилен реакция, получение
Ацетилен реакция получение уравнение открытие история
Осенью 1901 года был совершен дерзкий налет на кассу лондонской почты. Возможно, это событие не стоило бы вспоминать — сенсационные ограбления можно считать одной из многих английских традиций,— но оно косвенно связано с несколькими научными открытиями и изобретениями, одно из которых было сделано в том же 1901 году. Сейф лондонской почты впервые в мировой уголовной практике был вскрыт с помощью автогенного резака: сталь расплавило кислородно-ацетиленовое пламя.
ПЛАМЯ ГОРЯЧЕЕ И ЯРКОЕ
Пламя кислородно-ацетиленовой горелки (а резак можно считать ее разновидностью) раскалено до 3150° С. Это больше температуры плавления любого металла, исключая рений и вольфрам. Это больше температуры горения любой другой газовой смеси: максимальная температура водородно-кислородного пламени 2800° С.
Отошли в прошлое ацетиленовые фонари, электросварка сильно потеснила автогенную сварку, однако смесь кислорода с ацетиленом по-прежнему широко используют для резки и газопламенной обработки металлов. Отнюдь не с криминальными целями в одной только Англии ежегодно автогеном режут около 240 тысяч километров стального листа. Ео всех странах мира кислородно-ацетиленовое пламя используют для поверхностной закалки металлов, для снятия окалины, для зачистки заготовок. В строительстве и при ремонтных работах им пользуются для размягчения бетона. И трудно не согласиться с известным физиком Луи де Бройлем, который в 1951 году, выступая с речью по поводу 50-летия изобретения Шарлем Пикаром кислородно-ацетиленовой горелки, говорил: «Вовсе не обязательно ставить создание кислородно-ацетиленовой го
релки Е один ряд с открытием огня или изобретением паровой машины, но все-таки необходимо признать, что оно сыграло решающую роль в металлургии, в развитии техники сварки».
Изобретению Пикара предшествовали другие изобретения и открытия. За точку отсчета нужно, по-видимому, брать 1836 год, когда дублинский профессор химии Эдмунд Дэви, двоюродный брат знаменитого Хэмфри Дэви,, открыл ацетилен. На заседании Британской научной ассоциации он сообщил: «При попытке получить калий, сильно нагревая смесь прокаленного винного камня с древесным углем в большом железном сосуде, я получил черное вещество, которое легко разлагалось водой и образовывало газ, оказавшийся новым соединением углерода и водорода. Этот газ горит на воздухе ярким пламенем... Если подача воздуха ограничена, горение сопровождается обильным отложением сажи... Газ содержит столько же углерода, что и маслородный газ (этилен.— Е. Т.), но вдвое меньше водорода... Он удивительно подойдет для целей искусственного освещения, если только его можно будет дешево получать».
Эдмунд Дэви называл открытый им газ двууглеродистым водородом. Нынешнее же название ацетилена появилось лишь 24 года спустя. Известный французский химик Марселей Бертло тщательно исследовал ацетилен; он установил, что этот газ — первый углеводород гомологического ряда СпН2п_2, и ввел в химический обиход новый термин.
«Ацетилен» — от acetum — «уксус». Производя название нового газа от совершенно непохожей на него органической кислоты, Бертло подчеркивал, что в молекуле нового вещества тоже два атома углерода.
Бертло же первым синтезировал ацетилен из угля и водорода. Это случилось в 1862 году. И в том же году знаменитый немецкий химик Фридрих Вёлер, нагревая с углем сплав цинка и кальция, получил карбид кальция — вещество, каждый килограмм которого способен дать 300 литров ацетилена. Но промышленное производство карбида кальция нача-лось лишь через 30 лет.
Открытие Анри Муассаном экономически оправданного способа получения СаС2 (из обожженной извести и кокса или антрацита в электродуговых печах при температуре около 2000° С) предвосхитило недолгий век ацетиленового освещения. Не лишен интереса и тот факт, что способ получения СаС2, повторяющий по существу способ Муассана, в начале девяностных годов прошлого века был запатентован в разных странах разными исследователями (канадец Вильсон, американец Бэм, немец Боргерс, француз Бюлье — последний, гшавда, был ассистентом Муассана, его патент — это, видимо, тот патент, который мог взять, но не взял Муассан). Не будем разбираться, кто в действительности был самым- самым первым,— не о том наш рассказ. Важно, что открытие, как говорится, носилось в воздухе, и к нему практически одновременно пришли несколько ученых. Историки же отдают предпочтение Муассану — как изобретателю электридуговой печи. В таких печах карбид кальция получают и в наши дни.
Можно сказать, что XX век наступал в аце-тиленовом сиянии. Применявшийся раньше для освещения светильный газ не мог конкурировать с ацетиленом. Ацетилен ярче горел, и, главное, его можно было получать на месте потребления — из карбида и воды. Ацетиленовые фонари загорались всюду — на улицах и в домах, на фабриках и в отелях, на пароходах и автомобилях. Даже велосипедисты обзавелись ацетиленовыми фарами. К 1911 году мировое производство карбида кальция достигло 250 тысяч тонн, ацетиленовое пламя ос-вещало 965 городов.
В то же время повсеместное производство и применение ацетилена обнаружило главный его порок—взрывоопасность. Взрывы следовали один за другим. Предпринятыми исследованиями было установлено, что особенно опасен жидкий ацет клен, и вс многих странах было официально запрещено его использовать. Выяснилось также, что ацетилен легко реагирует со многими металлами и что некоторые ацэтилениды, особенно ацетиленид меди, чрезвычайно взрывоопасны. Пришлось удалять медь из всех ацетиленовых производств...
Тогда же было доказано, что раствор ацетилена в ацетоне (а он в нем растворяется отлично: литр ацетона при нормальных условиях способен поглотить 25, а при минус 80° С — 2000 литров ацетилена) не взрывоопасен. И в наше время ацетилен перевозят и хранят в виде ацетонового раствора в стальных баллонах, заполненных пористым веществом, чаще всего активированным углем.
Пламя ацетиленовых фонарей светит иногда и в наши дни, обычно на маяках и буях. Очень ярко это пламя, и, главное, ацетиленовый фонарь полностью автономен... Заметим тут же, что в наши дни ацетилен получают не только и не столько из карбида кальция, сколько из углеводородного сырья, прежде всего природного газа.
Ацетилен Тройная связь
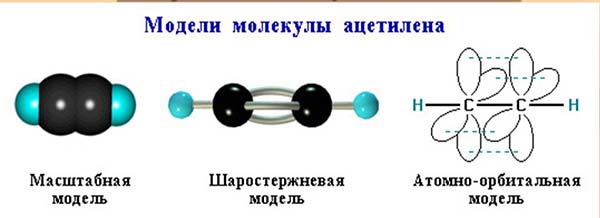
Нынешний интерес к ацетилену определяется прежде всего наличием в его молекуле тройной связи. Н —С=С — Н — такова структурная формула ацетилена.
Тройная связь непрочна, она легко разрушается под действием разных веществ и факторов. Она причина и взрывоопасности, и чрезвычайной химической активности ацетилена. Благодаря ей он легко вступает в реакции самых разных типов: присоединения, замещения, полимеризации. Одно только перечисление веществ, которые можно синтезировать из ацетилена, потребовало бы нескольких томов. Томов, а не страниц! Судите сами: средний словарь содержит 100 000 слов; органических соединений сейчас известно около трех миллионов; и очень многие из них можно полу-чить, используя в качестве сырья ацетилен Не случайно 70% производимого сейчас ацетилена идет на нужды химического синтеза.
Как же показать это многообразие, располагая лишь несколькими журнальными страницами? Некоторое время назад был распространен такой прием иллюстративной популяризации: рисовали «древо», стволом которого служило исходное вещество, а ветвями — то, что из него можно получить. Для ацетилена этот прием можно использовать лишь при условии, что ветками будут не отдельные вещества, а целые отрасли химической промышленности: производства синтетического каучука, пластмасс, искусственных волокон, пленочных материалов, растворителей, лаков, клеющих веществ, медикаментов... Что же до «листьев» — индивидуальных веществ, то с ними, наверное, лучше всего познакомиться, проследив важнейшие реакции ацетилена. Важнейшие — для современной промышленности органического синтеза.
Реакция гидрогенизации (присоединение во-дорода): НС=СН + Н2—*■ Н2С = СН2. Получается этилен. Эту реакцию в промышленных масштабах впервые использовали в Германии незадолго до второй мировой войны в связи с нехваткой нефтехимического сырья. В наше время, когда этилена (этиленовые фракции нефти и газа) достаточно, этот процесс используют для очистки этилена от ацетилена. А этилен, как и прежде, используют главным образом для получения полиэтилена и спирта, который в свою очередь перерабатывают в синтетический каучук и другие важные вещества.
<
Реакция гидратации (присоединение воды): НС = СН -}- Н20 —*- СН3 — СОН — уксусный альдегид. Катализатором служат соли ртути. Эта реакция носит имя выдающегося русского химика М Г. Кучерова, открывшего ее в 1884 году До последнего времени эта реакция имела большое практическое значение, поскольку уксусный альдегид легко окисляется до уксусной кислоты, которая служит сырьем для производства каучуков и пластмасс, ис-кусственного шелка и растворителей. Взаимо-действие уксусной кислоты с ацетиленом приводит к винилацетату, способному к полимеризации и сополимеризации.
В последнее время промышленное значение реакции Кучерова уменьшилось: разработан процесс прямого окисления этилена в уксусный альдегид, а этилен, как известно, стал доступнее ацетилена.
Та же реакция, но в иных условиях и с другими катализаторами (фосфорнокислые соли тяжелых металлов). Над ними пропускают смесь водяных паров и ацетилена. Температура 300—400° С. Реакция открыта другим выдающимся русским химиком — академиком Н. Д. Зелинским. В этих условиях параллельно идут два процесса — описанный в предыдущем абзаце и другой, продуктами которого служат углекислый газ, водород и ацетон — один из самых важных органических растворителей. Меняя условия реакции, варьируя катализаторы, добиваются 75%-ного выхода ацетона от теоретически возможного.
Реакция хлорирования: НС=СН + 2С12—*- —*- С12НС — СНС12. Здесь опущены все проме-жуточные соединения. Конечный же продукт — тетрахлорэтан — мог бы служить прекрасным растворителем, однако из-за токсичности в чистом виде его не используют, а перерабатывают в трихлорэтилен (тоже очень хороший растворитель, но значительно менее ядовитый) и другие хлорсодержащие продукты, в частности гексахлорэтан — заменитель камфары в нитроцеллюлозных пластмассах и интенсификатор свечения пиротехнических составов.
Реакция гидрохлорирования (присоединение хлористого водорода): НС=СН+НС1—*■ —*- Н2С = СНС1. В присутствии солей меди (катализатор) образуется винилхлорид, мономер поливинилхлорида—одного из важнейших пластиков. О поливинилхлориде рассказывать здесь не будем, адресуя читателя к статье «Хлор» («Химия и жизнь», 1969, № 4).
Реакция присоединения синильной кислоты: НС = СН -f HCN—*- Н2С = СН — CN. Продукт этой реакции акрилонитрил необходим для получения некоторых пластмасс, синтетического волокна «нитрон» и нового искусствен
ного волокна, наиболее близкого по свойствам к натуральному шелку (о нем рассказано в «Химии и жизни», 1973, № 1).
°еакции присоединения спиртов: КС=СН+ + ROH —- Н2С = CHOR. Конечные продукты этой реакции — простые виниловые эфиры. На возможность получения их из ацетилена еще в 1888 году указывал выдающийся русский химик А. Е. Фаворский. Но лишь спустя полвека этот синтез приобрел промышленное значение. Сейчас полимеры на основе этих эфиров используют в качестве смазок и гид равлииеских жидкостей. А один из них —полимер винилб.утилового эфира (сырье — ацетилен и бутиловый спирт) — известен в медицине под названием бальзама Шостаковского. Его применяют при ранениях, трофических язвах, ожогах, воспалительных процессах...
До сих пор мы рассматривали только реакции присоединения ацетилена и продукты этих реакций. И хотя в эту часть рассказа часто вклинивались понятия «полимеры», «полимеризация», не о них шла речь. Однако, рассказывая об ацетилене, не уйти от его собственных полимеров. Одно из самых знаменитых органических веществ бензол — это тример ацетилена. Бще Бертло установил, что над активированным углем ацетилен легко полимери- зуется, превращаясь в бензол: ЗНСггСН —»- — С6Н6.
Бензол открыт М. Фарадеем в 1825 году, С винилацетиленом, продуктом взаимодействия двух ацетиленовых молекул, человечество познакомилось лишь через сто с лишним лет. Это вещество Н2С = СН—С=СН, свойства которого определяются главным образом тройной и в меньшей степени двойной связью. Известный американский химик У. Карозерс обнаружил, что в присутствии хлоридов одновалентной меди и аммония винилацетилен присоединяет хлористый водород. Продукт этой реакции называют хлоропреном. Следовательно, ацетилен можно считать прародителем хлоропренового каучука.
В те же тридцатые годы академик А. Е. Фа-ворский, посвятивший химии ацетилена 60 лет научной деятельности, получил из ацетилена и ацетона еще один пслимеризующийся продукт. Его формула — C5Hs. Это изопрен — мономер изопоенового каучука.
Из винилацетилена и ацетона советский химик академик И. Н. Назаров получил универсальный карбинольный клей, в годы войны широко применявшийся для ремонта военной техники. А позже, продолжая исследования винилацетилена, И. Н. Назаров получил известный обезболивающий препарат промедол.
Академик А. £ Фаворский (1860—1945) — основатель советской школы химии ацетилене
Можно было бы рассказать еще о многом, но рамки журнальной статьи вынуждают оставить «за кадром» многие аспекты химии ацетилена...
Вероятно, внимательный читатель обратил внимание на определенный исторический уклон этого рассказа. Это закономерно: в последнее время с ацетиленом успешно конкурируют другие, более дешевые непредельные углеводороды, прежде всего этилен и е/о гомологи — пропилен и бутилен. Нефтегазовое сырье содержит больше углеводородов этого ряда. Тем не менее ацетиленовое «древо» не перестает разрастаться.
Е. Д ТЕРЛЕЦКИЙ Химия и жизнь
Поделиться с друзьями
