Сорбционные явления
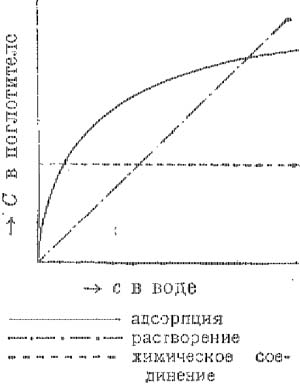
Сорбционные явления (у биоколлоидов) (от лат. sorbere—поглощать), процессы, связанные с поглощением жидкостью или твердым телом веществ, находящихся в соприкасающейся среде. Различают три основных вида сорпции: растворение, или абсорпцию, поверхностную конденсацию, или адсорпцию, и поглощение путем хим. связывания. Эти три вида С. я. в своих типичных формах резко отличаются друг от друга. Главным признаком, позволяющим решать вопрос о способе связывания исследуемого вещества, служит количественное соотношение, устанавливающееся в состоянии равновесия между его концентрацией в обеих соприкасающихся фазах. В случае абсорпции, или растворения, количество поглощаемого вещества пропорционально его концентрации во второй фазе (закон Генри). Другими словами, соотношение концентрации данного вещества в обеих фазах представляет постоянную величину; последняя получила название коефициента распределения. Напротив, в случае адсорпции (см.) концентрация адсорбируемого вещества возрастает медленнее, чем его концентрация в соприкасающейся фазе. Если обозначить последнюю через с, то содержание поглощаемого вещества, приходящееся на 1 з адсорбера, равняется С=ксп, где 1с и п— константы, причем п всегда меньше единицы (обычно значения п лежат между 0,1 и 0,6). Впрочем это уравнение (изотерма адсорпции Фрейндлиха) соблюдается лишь при условии, если концентрация относительно невелика. В противном случае, как показал Ленгмюр (Langmuir), количество адсорбированного вещества приближается к нек-рому пределу, после чего дальнейший рост его прекращается (насыщение адсорпционного слоя). Наконец в случае хим. связывания все прибавляемое вещество полностью (независимо от ого концентрации) связывается поглотителем до тех пор, пока реакция не закончится, после чего его содержание в поглотителе остается неизменным. Существующие в этих трех случаях количественные соотношения представлены на рисунке, в к-ром на оси абсцисс отложена концентрация поглощаемого вещества в соприкасающейся с поглотителем фазе, на оси ординат— его содержание в самом поглотителе..
Впрочем далеко не всегда между разными видами сорпции существуют столь резкие различия, позволяющие без труда отличать их друг от друга. Так напр.в случае растворения между концентрациями исследуемого вещества в
обоих растворителях существует прямая пропорциональность лишь при условии, если оно находится в них в одинаковом молекулярном состоянии. В противном случае получаются более сложные зависимости, близкие к тем, к-рые характерны для адсорпции. Так, бензойная к-та состоит в воде из простых, в бензоле же—из ассоциированных, двойных молекул. Как показывает расчет, ее концентрация в воде пропорциональна корню квадратному из ее концентрации в бензоле. Подобным же образом электролиты, сильно диссоциированные в воде, находятся в недиссоциированном или мало, диссоциированном состоянии в неводных растворителях. Поэтому их ионы практически полностью собираются в воде, между тем как их недиссо-циированные молекулы распределяются пропорционально между обеими фазами. Вследствие этого по мере уменьшения концентрации электролита одновременно с увеличением степени его диссоциации возрастает его относительное содержание в воде. В свою очередь и для адсорпции нередко получаются значительные осложнения. Это в частности имеет место в тех случаях, когда поверхностная конденсация представляет лишь первый этап процесса поглощения, за к-рым следует хим. взаимодействие между адсорбированным веществом и самим адсорбером. Наконец в случае лабильного, легко диссоциирующего химического соединения количество химически связанного вещества находится в равновесии с его концентрацией в растворе и изменяется в зависимости от последней. Таким образом в целом ряде случаев только более точный анализ позволяет установить, к какому типу сорпции относится изучаемое явление. д. Рубинштейн.
